单抗药物如何攻克阿尔茨海默症 靶点大揭秘_MedChemExpress(MCE 中国)
老年痴呆!它还有个洋气的名字——阿尔茨海默症。一种常见的神经退行性疾病,病理现象主要涉及 β-淀粉样蛋白斑块、神经纤维缠结、神经元丧失和炎症反应等。近年来,其对应靶点的治疗药物也层出不穷……
Aducanumab 在 2021 年 6 月 7 日获得 FDA 加速批准上市,是第一个被 FDA 批准用于 AD 的新药,用于 AD 源性轻度认知障碍 (MCI) 及轻度 AD 的治疗。2023 年 1 月 6 日,FDA 批准 Lecanemab 上市,用于治疗伴有轻度认知功能障碍或轻度痴呆的早期 AD。这标志着利用单抗药物作为阿尔茨海默症治疗手段的可行性得到了认可。
本期小 M 就为大家盘点下都有哪些治疗阿尔茨海默症的单抗药物!
Section.01
靶向 β-淀粉样蛋白 (Aβ) 的
单抗药物
淀粉样蛋白前体蛋白 (APPs) 是天然存在于大多数组织中的跨膜蛋白。α-分泌酶将 APP 裂解成可溶性肽。然而,通过 β 分泌酶和随后的 γ 分泌酶,产生淀粉样蛋白 β 单体 Aβ1-40 和 Aβ1-42,然后形成低聚物和大聚合物。β 淀粉样蛋白以多种形式存在,例如单体、寡聚体、原纤维和原纤维。寡聚体和原纤维具有神经毒性。淀粉样蛋白级联假说 (ACH) 规定,越来越多的聚集细胞外 Aβ,特别是可溶性寡聚物,具有神经毒性,促进 tau 蛋白分解,并形成神经原纤维缠结。这导致神经元死亡,表现为临床前疾病,最终发展为阿尔茨海默症。
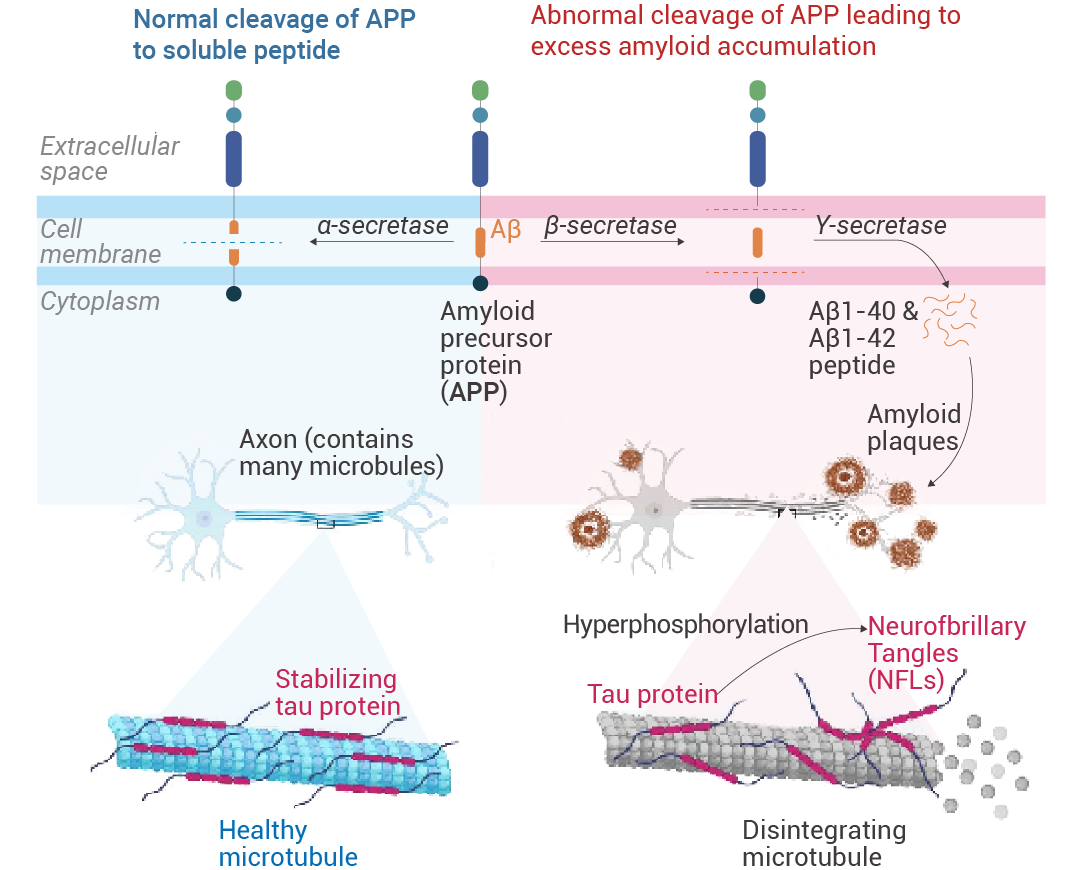
图 1. 阿尔茨海默症的病理生理学[1]。
Aducanumab (阿杜那单抗) 是一种高亲和力、靶向- Aβ 构象表位的全人 IgG1 单克隆抗体。它能够有选择性地与 AD 患者大脑中的淀粉样蛋白沉积结合,然后通过激活免疫系统,将大脑中的沉积蛋白清除。
Aducanumab 于 2021 年 6 月在美国获 FDA 批准上市,是自 2003 年以来获批用于治疗阿尔茨海默症的新疗法。在临床前研究中,Aducanumab 可以穿透血脑屏障,靶向淀粉样斑块并将其从转基因小鼠大脑中清除。Aducanumab 临床研究在 3,482 名阿尔茨海默病患者中进行,分为三项独立的研究,包括双盲、安慰剂对照、随机和剂量范围方式。临床评估结果表明,接受治疗的患者 Aβ-淀粉样蛋白在剂量和时间依赖性方面显着减少,而对照组患者的 Aβ-淀粉样蛋白斑块没有减少。
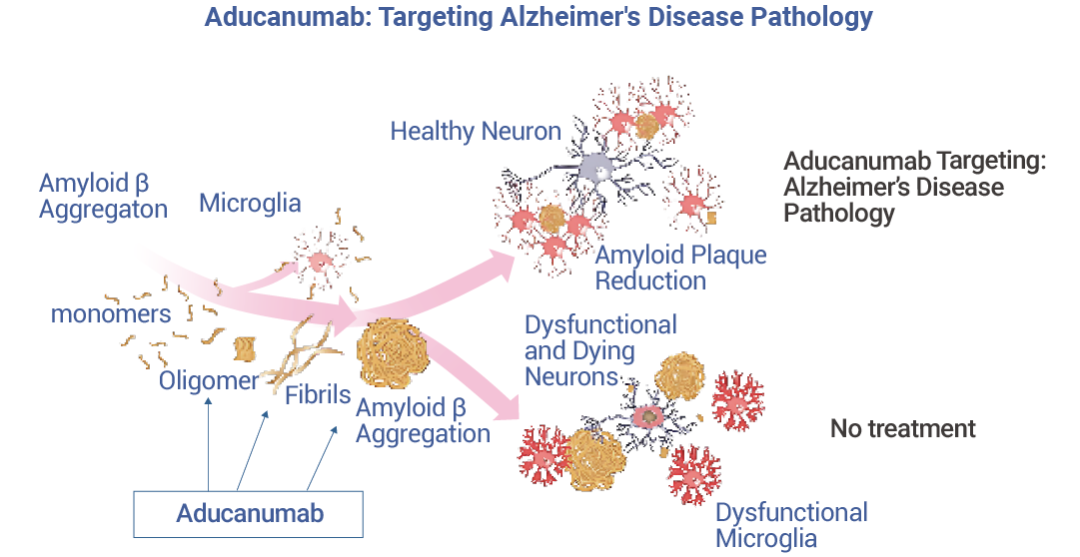
图 2. Aducanumab 的作用机制[2]。
Lecanemab (仑卡奈单抗) 是鼠抗体 mAb158 的人源化 IgG1 形式,已被证明可降低致病性 Aβ,防止 Aβ 沉积,并特异性地减少 AD 动物模型中大脑和 CSF 中的 Aβ 原纤维。Aβ 原纤维的选择性靶标将 Lecanemab 与其他抗淀粉样蛋白 mAb 区分开来。Lecanemab 是有效的第二代单克隆抗体,用于免疫耗竭 Aβ 原纤维,尤其是可溶性原纤维和寡聚体。Lecanemab 结合可溶性原纤维的亲和力是 Aducanumab 的 100 倍,与不溶性原纤维的亲和力是 25 倍,对单体的结合亲和力较低。2023 年 7 月美国 FDA 全面批准它用于治疗阿尔茨海默病 (AD) 导致的轻度认知功能损害和早期痴呆。
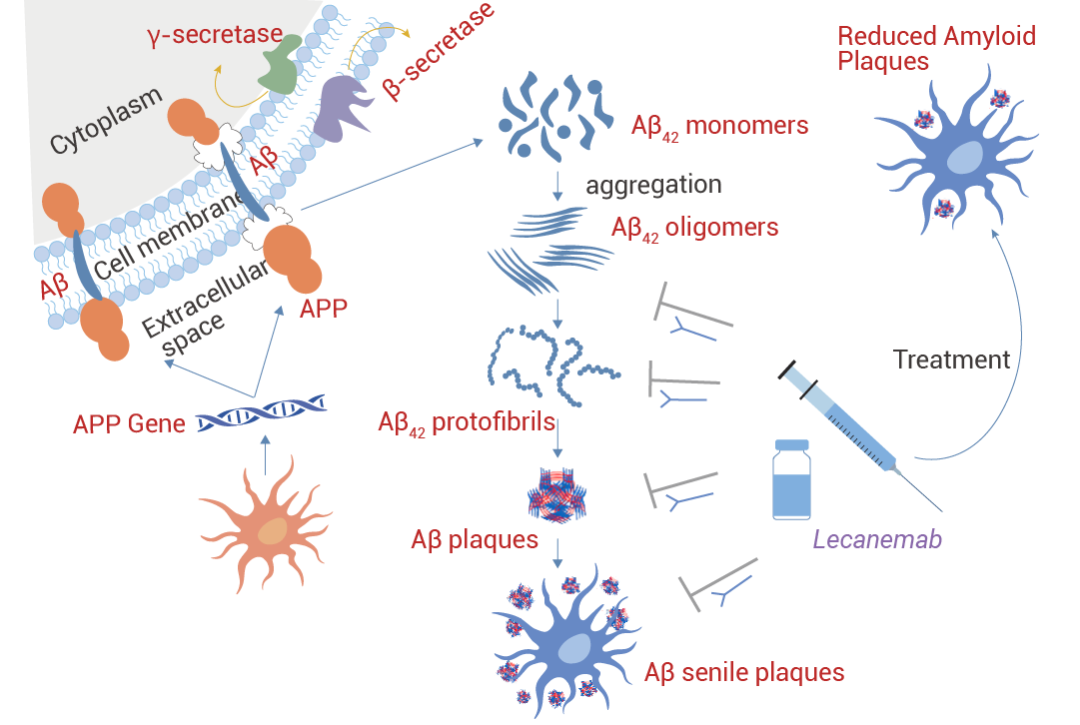
图 3. Lecanemab 的作用机制[3]。
Donanemab (多奈单抗) 是人源化 IgG1 抗体,靶向 N 端 Aβ 表位,并通过小胶质细胞介导的吞噬作用帮助去除斑块。Donanemab 的开发旨在通过小胶质细胞介导的吞噬作用去除现有的淀粉样蛋白斑块。在老年淀粉样蛋白前体蛋白转基因小鼠中施用 Donanemab 可导致剂量依赖性斑块减少,而无微出血倾向。Donanemab 不与其他 Aβ 物种、神经递质或其受体的脱靶结合,并且没有已知的症状效应。
Bapineuzumab (巴匹珠单抗) 是小鼠单克隆抗体 3D6 的人源化形式,靶向 Aβ 的 N 端区域。这种被动免疫疗法的基本原理是抗体结合会清除过量的 Aβ。支持 Bapineuzumab 的临床前研究中,有很大一部分是通过 3D6 评价的。研究表明,外周给药的一小部分抗体进入了中枢神经系统。该抗体能与淀粉样蛋白斑块结合,降低斑块负荷,改善突触毒性测量,并改善小鼠行为测定的表现。此外,II 期临床试验表明,Bapineuzumab 可以降低正电子发射断层扫描 (PET) 上淀粉样蛋白的负荷和脑脊液中磷酸化 tau 蛋白的浓度。
Solanezumab (索拉珠单抗) 是一种针对 Aβ 肽中间结构域的人源化单克隆 IgG1 抗体。它识别可溶性单体 Aβ,而不是原纤维 Aβ。在临床前研究中,单次注射 M266 (Solanezumab 的小鼠版本) 可逆转 APP 转基因小鼠模型中的记忆缺陷,同时保留淀粉样蛋白斑块,提高了靶向 Aβ 可溶性库的可能性。临床前阿尔茨海默病患者的 3 期试验中,Solanezumab 靶向脑淀粉样蛋白水平升高患者的单体淀粉样蛋白。但与安慰剂相比,Solanezumab 在 240 周的时间内并没有减缓临床前阿尔茨海默病患者的认知能力下降。
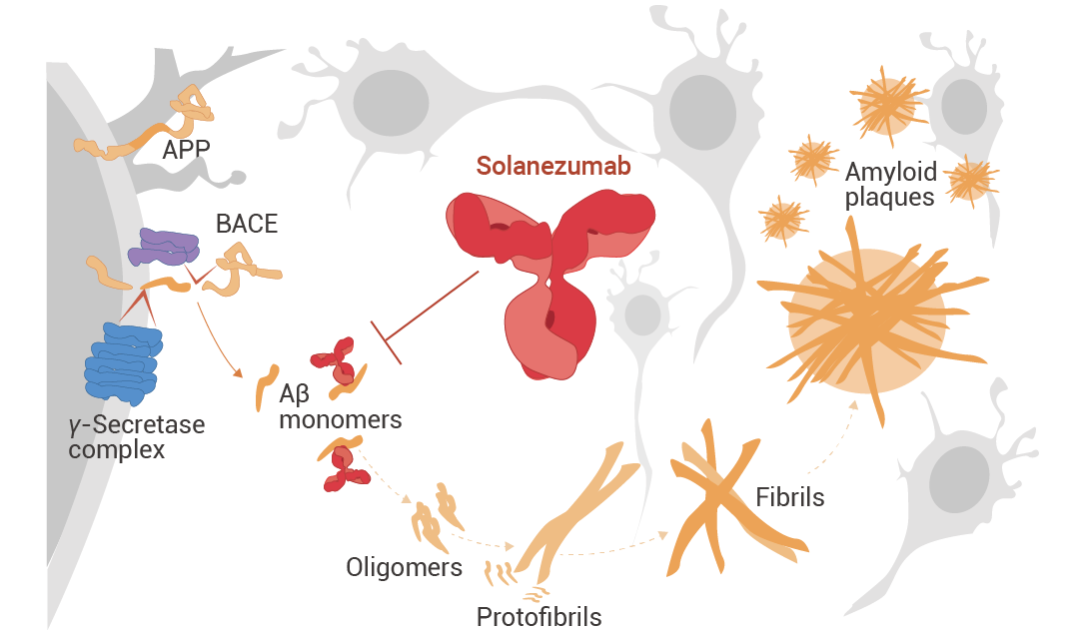
图 4. Solanezumab 的作用机制[4]。
Gantenerumab (更汀芦单抗) 是一种全人源 IgG1 抗体,以亚纳摩尔亲和力结合 Aβ 原纤维上的构象表位。它包含 Aβ 的 N 末端和中心氨基酸。该抗体通过募集小胶质细胞和激活吞噬作用,集中作用以分解和降解淀粉样蛋白斑块。Gantenerumab 优先与聚集的脑 Aβ 相互作用,包括实质和血管。它还中和寡聚 Aβ42 介导的对大鼠大脑长期增强的抑制作用。在 APP/PS-1 转基因小鼠中,gantenerumab 与脑 Aβ 结合,通过募集小胶质细胞来减少小斑块,并防止新斑块的形成。
Crenezumab (克瑞组单抗) 是一种人源化 IgG4 抗体,可识别多种形式的聚集 Aβ,包括具有高亲和力的寡聚体和原纤维物种,以及低亲和力的单体 Aβ。与 IgG1 相比,Crenezumab 的 IgG4 骨架赋予减少的 FcγR 激活,并被证明可以最大限度地减少 FcγR 介导的小胶质细胞炎症激活。Crenezumab 刺激淀粉样蛋白吞噬作用,同时限制炎性细胞因子的释放,以避免血管源性水肿等副作用。值得注意的是,Crenezumab 螯合了 Aβ 的疏水核心,打破了 β-hairpin 构象的基本盐桥特征,消除了 Aβ 寡聚体和原纤维中基本特征。
Section.02
靶向 tau 蛋白的单抗药物
tau 是由 352-441 个氨基酸形成的中枢神经系统重要蛋白,由 17 号染色体上的 MAPT 基因编码,可产生 6 种亚型。tau 的主要功能是促进神经元轴突中微管的组装和稳定。tau 与微管的结合受其磷酸化/去磷酸化平衡的调节。在生理条件下,tau 被展开和磷酸化,而病理形式的特征是过度磷酸化导致从微管脱离,以及构象变化导致形成异常磷酸化 tau 的成对螺旋和直丝,随后形成 tau 聚集体。这些聚集体会导致神经元和神经胶质细胞退化,最终导致各种临床认知、行为和运动表现,这些表现被归类为不同类型的神经退行性疾病,称为 “tau 蛋白病”。
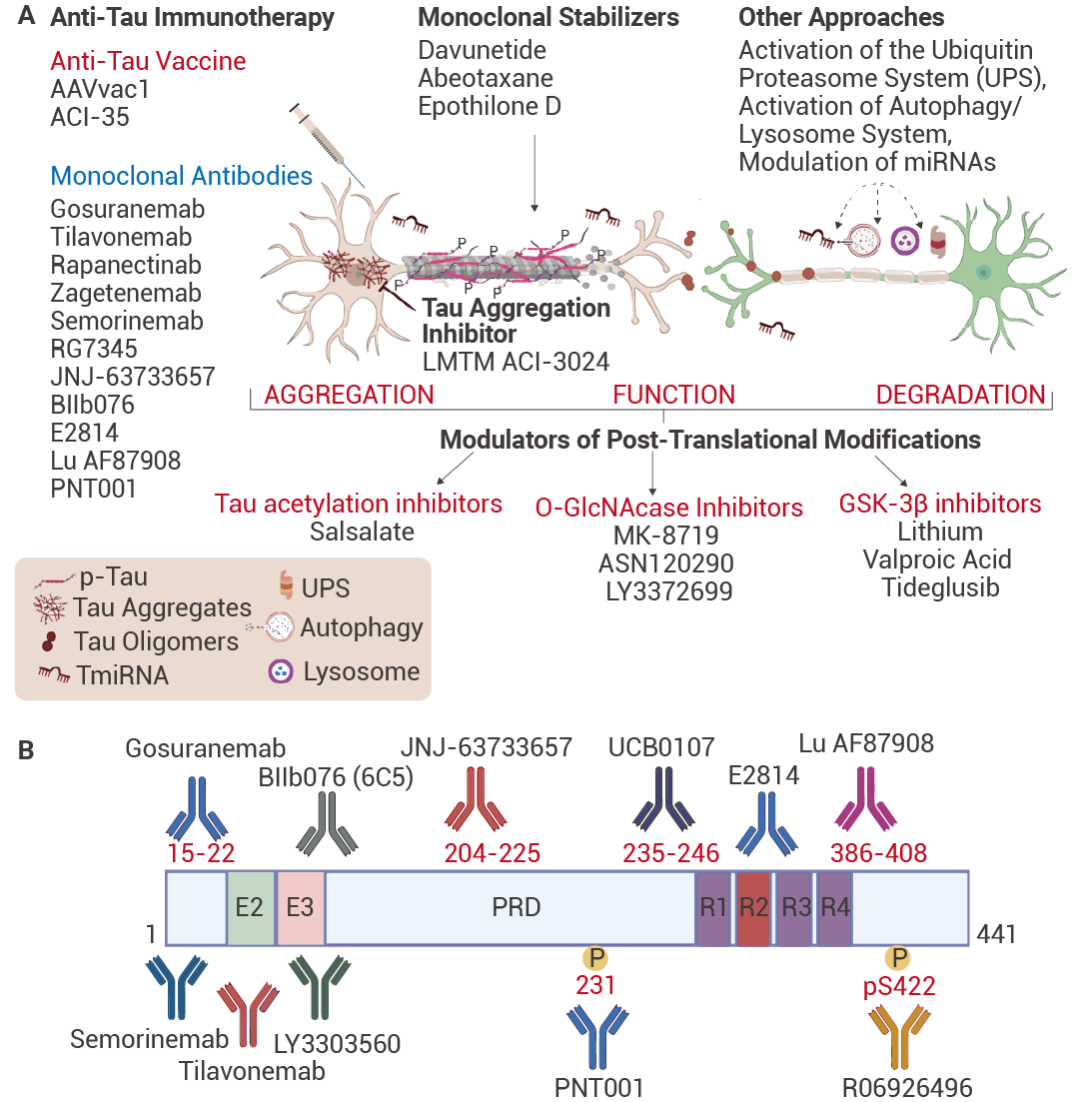
图 5. 对于目前正在临床试验中的 tau 蛋白抗体药物[5]。
Gosuranemab (戈奈单抗) 是一种人源化 IgG4 单克隆抗 tau 抗体,靶向细胞外 tau N 端片段 (eTau),这些片段最初是从家族性 AD 患者来源的多能干细胞中分离的。eTau 被认为参与 tau 蛋白病病理学的传播,Gosuranemab 在额颞叶痴呆小鼠模型中中和 eTau 的毒性。结合实验表明,Gosuranemab 对来自不同 tau 蛋白病的 tau 单体、tau 原纤维和不溶性 tau 表现出高亲和力。使用 X 射线晶体学和诱变进行的表位定位研究表明,Gosuranemab 与人 tau15-22 残基结合。
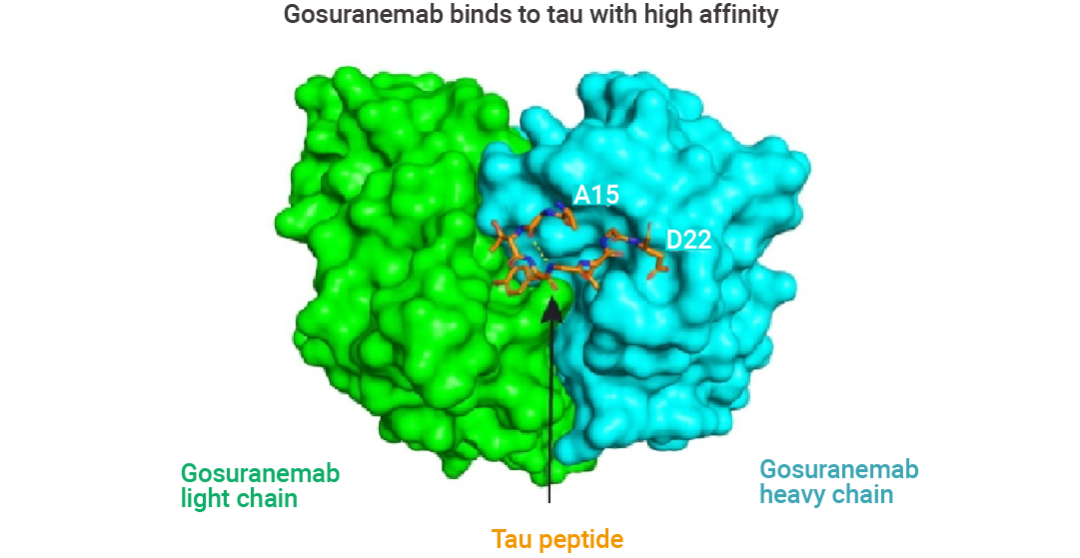
图 6. Gosuranemab 与 tau 的晶体结构[6]。
青色表示重链,绿色表示轻链,橙色表示 tau 肽。
Semorinemab (西瑞奈单抗) 是一种 IgG4 单克隆抗 tau 抗体,结合人 tau 的所有六种亚型的 N 端,包括单体和寡聚体,在神经元和小胶质细胞共培养中能够保护神经元免受 tau 寡聚体神经毒性的影响。此外在转基因小鼠 tau 病变模型中,小鼠版本的 Semorinemab 每周一次腹膜内给药 13 周后,减少 tau 病理的积累,与抗体效应功能状态无关。在 1 期临床试验中,单剂量高达 16,800 mg,一个月内多剂量总计 33,600 mg,没有观察到令人担忧的安全信号。与健康对照参与者相比,AD 参与者在服药后观察到系统性 tau 浓度更高。
Tilavonemab (替拉奈单抗) 是一种人源化 IgG4 抗体,它识别一种聚集的细胞外病理性 tau 形式,与 tau 的 N 端结合。Tilavonemab 与其他一些抗 tau 抗体的不同之处在于,其作用机制不需要被神经元摄取。在 P301S tau 转基因小鼠中,Tilavonemab 可以减少脑神经原纤维病理、不溶性 tau、小胶质细胞增生、处理过的脑裂解物的接种活性和条件性恐惧反应的缺陷。在一项 1 期单次递增剂量研究 (NCT02494024) 和一项 2 期随机安慰剂对照试验 (NCT02985879) 中,Tilavonemab 耐受性良好,但未对患者有效。
Zagotenemab (泽格特奈单抗) 是人源化 IgG4 抗体,靶向源自 MCI-1 的 tau 的 7-9 和 312-342 个氨基酸。Zagotenemab 结合并中和可溶性 tau 聚集体。在临床前研究中,通过涉及转基因小鼠和非人灵长类动物的研究,突出了 Zagotenemab 亲本抗体的疗效。当转基因小鼠用 MCI-1 处理时,观察到磷酸化 tau 水平和神经原纤维病理显著降低。这种效应归因于 tau/抗体复合物的清除,由小胶质细胞依赖性或神经元依赖性机制。此外,与单体相反,它表现出与 tau 聚集体的选择性和高亲和力结合。在非人灵长类动物中,Zagotenemab 在血清中的半衰期为 13 天,清除率为 0.15 mL/h/kg。
Bepranemab (贝瑞奈单抗) 是一种人源化单克隆 IgG4 抗体,与 tau 的中心区域结合,识别 tau 微管结合结构域附近的 235-250 氨基酸。与 N 末端靶向的抗 tau 抗体相比,Bepranemab 更干扰致病性聚集性 tau 的细胞间传播与靶向 tau N 端区域的抗体相比,靶向 tau 中区的抗体似乎更有可能破坏病原性和聚集的 tau 在细胞之间的传递。在转基因小鼠的实验中,它成功地避免了通过注射源自阿尔茨海默病脑提取物的 tau 诱导的 tau 病理学的发作。此外,它还证明了阻止 tau 病理学传播到远处大脑区域的能力。另一个重要方面是其人 IgG4 种型,表明消除与抗体结合的 tau 可能不依赖于小胶质细胞吞噬作用。这种特征为其在减轻与 tau 蛋白相关的神经退行性病变引入了额外的复杂性。
Posdinemab (JNJ-63733657) 是一种人源化 IgG1 单克隆抗体,结合富含脯氨酸的 tau 结构域。与靶向 tau 的 N 端的抗体相比,Posdinemab 更能有效地干扰致病性聚集的 tau 的细胞间传播。它对在残基 217 处磷酸化的 tau 具有高亲和力。Posdinemab 可在基于细胞的测定中消除致病性 tau“种子”,并抑制小鼠模型中 tau 病理学的扩散。
MCE 为广大客户提供高质量,高纯度的抗体抑制剂产品,包括:单克隆抗体、双特异性抗体、融合蛋白、大鼠/小鼠体内抗体、同型对照抗体等,经 SDS-PAGE,SEC-HPLC 验证纯度大于 95%,内毒素小于 1 EU/mg,可用于体内研究。
产品推荐 |
β-Amyloid (25-35) HY-P0128 β-Amyloid (25-35) (Amyloid beta-peptide (25-35)) 是阿尔茨海默氏淀粉样蛋白 β 肽的 Aβ (25-35) 片段,在培养细胞中显示出神经毒性活性。 |
β-Amyloid (1-42), human HY-P1363A β-Amyloid (1-42), human (Amyloid β-peptide (1-42), human) 是由 42 个氨基酸组成的肽,其在阿尔茨海默病的发病机制中起关键作用。 |
Lecanemab (Mouse IGG2a) HY-P990110 Lecanemab (Mouse IGG2a) 是一种靶向可溶性 β-amyloid 的单克隆抗体,具有减轻认知下降的作用。 |
Semorinemab HY-P99399 Semorinemab (RG 6100) 是一种抗 Tau 人源化 IgG4 单克隆抗体,靶向 Tau 蛋白的 N 端部分 (氨基酸残基 6-23)。 |
Gantenerumab HY-P99022 Gantenerumab 是一种人源的抗淀粉样蛋白-β (Aβ) IgG1 单克隆抗体,显示出持续的脑淀粉样蛋白-β 结合。 |
Aducanumab HY-P9967 Aducanumab (BIIB037) 是一种选择性靶向聚集的 β 淀粉样蛋白 (Aβ) 的人单克隆抗体。 |
Bapineuzumab HY-P99185 Bapineuzumab 是一种抗 β-淀粉样蛋白 (APP) 单克隆抗体。Bapineuzumab 可用于阿尔茨海默病 (AD) 的研究。 |
Bepranemab HY-P99471 Bepranemab (UCB 0107) 是一种人源化全长 IgG4 单克隆抗体。Bepranemab 靶向 tau 蛋白的中心部分,特别是 235 至 246 位氨基酸。Bepranemab 可用于阿尔茨海默病 (AD) 研究。 |

[1] Qi X, et al. Disease Modifying Monoclonal Antibodies and Symptomatic Pharmacological Treatment for Alzheimer's Disease. Biomedicines. 2024 Nov 19;12(11):2636.
[2] Esang M, et al. Aducanumab as a Novel Treatment for Alzheimer's Disease: A Decade of Hope, Controversies, and the Future. Cureus. 2021 Aug 31;13(8):e17591.
[3] Chowdhury S, et al. Novel anti-amyloid-beta (Aβ) monoclonal antibody lecanemab for Alzheimer's disease: A systematic review. Int J Immunopathol Pharmacol. 2023 Jan-Dec;37:3946320231209839.
[4] Sperling RA, et al. Trial of Solanezumab in Preclinical Alzheimer's Disease. N Engl J Med. 2023 Sep 21;389(12):1096-1107.
[5] Imbimbo BP, et al. Initial failures of anti-tau antibodies in Alzheimer's disease are reminiscent of the amyloid-β story. Neural Regen Res. 2023 Jan;18(1):117-118.
[6] Sopko R, et al. Characterization of tau binding by gosuranemab. Neurobiol Dis. 2020 Dec;146:105120.

免责声明
- 凡本网注明“来源:化工仪器网”的所有作品,均为浙江兴旺宝明通网络有限公司-化工仪器网合法拥有版权或有权使用的作品,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已经本网授权使用作品的,应在授权范围内使用,并注明“来源:化工仪器网”。违反上述声明者,本网将追究其相关法律责任。
- 本网转载并注明自其他来源(非化工仪器网)的作品,目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品第一来源,并自负版权等法律责任。
- 如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。
 手机版
手机版 化工仪器网手机版
化工仪器网手机版
 化工仪器网小程序
化工仪器网小程序
 官方微信
官方微信 公众号:chem17
公众号:chem17
 扫码关注视频号
扫码关注视频号



















 采购中心
采购中心