基因治疗是目前生物医药领域的话题之一,生物医药行业对基因治疗持续高涨的热情,令该领域许多公司开始将一次治愈性基因疗法,作为其开发的战略核心。
有行业报告显示,未来预计 6 年内,将有多达 60 种基因疗法获得批准,这些基因疗法在 2024 年的销售额将达到 146 亿美元。
基因治疗的核心是基因载体,病毒载体占据着主导地位。目前腺相关病毒(AAV)和慢病毒(LV)是临床上泛使用的病毒载体。
从 2012 年荷兰 UniQure 公司的,世界上AAV 基因治疗药物 Glybera 在欧盟获上市,到 2016 年 GSK 与意大利 San Raffaele Telethon 合作开发的 LV 基因治疗药物 Strimvelis 再次在欧盟获批,再到 2017 年诺华获得 FDA 肿瘤药物咨询委员会以 10:0 的投票结果,一致批准的自体回输 CAR-T 细胞疗,及同年 Spark Therapeutics 公司获 FDA 批准的个传疾病的基因治疗药物 Luxturna,AAV 和 LV 越来越成为基因治疗的主角。AAV 和 LV 大都采用质粒瞬时转染方法生产,从而高质量、高纯度的质粒是制 AAV、LV 等病毒载体的前提条件。

质粒是常见的分子生物学工具,是一段 DNA 双螺旋结构。而抽提质粒几乎是分子生物学基础实验之一。
科研水平的实验,通常的质粒抽提试剂盒就足以满足微克至数毫克级的需求,但是如果需要大规模制备病毒载体,试剂盒的质粒产量就非常的力不从心了。
此外,包装病毒通常需要三个质粒或四个质粒,每个质粒大小、序列都不一样,上游表达量也有区别,甚至稳定性都有差异。
面对如此众多品种的质粒,有没有一种质粒 DNA 纯化平台,能够适用多种质粒的、可放大的,满足基因治疗、细胞治疗和疫苗的高纯度和同质性的标准要求,并且还需要有效,稳健和可扩展的下游过程呢?

接下来为大家隆重介绍 BIA Separations 提供的,基于对流相互作用介质(CIM)层析整体柱的两步质粒 DNA(pDNA)纯化平台!
该方法除了具有以上全部优点,并且可以明显降低纯化时间,提高生产效率,使其成为 GMP 环境下的大规模 pDNA 纯化的选择。
该方法专为纯化大分子和纳米颗粒的整体柱而设计,可实现快速操作,高流量,同时提供动态结合能力和分辨率。

首先要为整个过程中的核心——两步层析步骤,准备细菌培养液
1. 大肠杆菌收获、裂解-碱裂解:
这是快速高效纯化质粒 DNA 亚型的基础。
操作建议:
 先收集菌体;
先收集菌体; 然后采用碱性裂解法制备原料;
然后采用碱性裂解法制备原料;
 再将细菌细胞(通常是细胞生物质或细胞沉淀)悬浮在 50 mMTris-HCl,10 mM EDTA,pH8.0 中;
再将细菌细胞(通常是细胞生物质或细胞沉淀)悬浮在 50 mMTris-HCl,10 mM EDTA,pH8.0 中;
 通过加入等体积的 0.1-0.4M NaOH,1%SDS 进行裂解。
通过加入等体积的 0.1-0.4M NaOH,1%SDS 进行裂解。
2. 裂解液浓缩:
氯化钙沉淀后澄清,除去了大量的主要样品杂质
 裂解后,悬浮液变粘稠,通过加入与悬浮缓冲液等体积的,4-8℃ 冷却的 3M CH 3 COOK(pH 5.5)沉淀细胞碎片和 SDS 复合物。
裂解后,悬浮液变粘稠,通过加入与悬浮缓冲液等体积的,4-8℃ 冷却的 3M CH 3 COOK(pH 5.5)沉淀细胞碎片和 SDS 复合物。
 在温和混合下,缓慢加入 CaCl2 并孵育 15 分钟。
在温和混合下,缓慢加入 CaCl2 并孵育 15 分钟。
TIPS:
1. 氯化钙用作沉淀剂,以去除 RNA、基因组 DNA 和其他杂质;
2. 较高浓度的杂质需要 CaCl2 浓度高达 1M;
3. 考虑测试多种浓度并评估产品中杂质的有效去除和未受影响的 pDNA 产量;
4. 加入速度应该很慢,以防止局部温度上升;
5. 孵育后,进行一系列澄清步骤,从离心或粗过滤开始,例如 80μm 深度过滤,并以 1-5μm 过滤结束。
(低温有利于沉淀,混合过程应该温和操作,以防止 DNA 降解。)

前面 blabla 说了那么多,然而纯化才是本工艺的精华所在。
BIA Separations 的二步纯化工艺的稳健性、连贯性、时效性,均堪称教科书式的经典。
一步纯化的柱子,通过弱阴离子交换,浓缩 pDNA 并去除大部分 HCP、mRNA 和基因组 DNA;
第二步利用疏水相互作用色谱(HIC)的抛光步骤,进一步从超螺旋(SC)治疗级 pDNA 中除去开环(OC)和线性 pDNA 亚型。
两步纯化的作用功能明确、互相合作,大大节省操作步骤和时间。

 AEX 色谱柱(CIMmultus™DEAE)浓缩 pDNA,并去除大部分 HCP、mRNA 和基因组 DNA。
AEX 色谱柱(CIMmultus™DEAE)浓缩 pDNA,并去除大部分 HCP、mRNA 和基因组 DNA。
 在弱阴离子交换柱上捕获质粒 DNA,其中除去剩余的 RNA 和蛋白质,样品结合需要低电导率,通过稀释实现。
在弱阴离子交换柱上捕获质粒 DNA,其中除去剩余的 RNA 和蛋白质,样品结合需要低电导率,通过稀释实现。
 随着增加 NaCl 的梯度洗脱,首先洗脱 RNA,然后洗脱质粒 DNA。
随着增加 NaCl 的梯度洗脱,首先洗脱 RNA,然后洗脱质粒 DNA。
层析条件
Monolithic column: | CIMmultus™ DEAE(2 µm)*1 |
Mobile phase: | Equilibration buffer A1: 50 mM Tris, 10 mM EDTA, pH 7.2 |
Washing buffer A2: 50 mM Tris, 10 mM EDTA, 0.6 M NaCl, pH 7.2 | |
Elution buffer A3: 50 mM Tris, 10 mM EDTA, 1 M NaCl, pH 7.2 | |
Working flow rates: | 0.5 – 5 column volume (CV) /min (具体取决于样品特性,使用的层析设备和色谱柱尺寸) |
*1 选择色谱柱体积,取决于需要处理的样品量。
层析方法
1. 用去离子水稀释细菌裂解物至电导率为 35-40mS / cm。稀释取决于样品制备过程中添加的 CaCl2 浓度。
2. 将稀释的样品用 0.45μm 过滤器进行过滤。
3. 将 20CV 的缓冲液 A1 平衡 DEAE 柱。
4. 将澄清的稀释细菌裂解液进行上样。
5. 用 20 CV 的缓冲液 A1 对色谱柱进行流洗。
6. 用 20 CV 的缓冲液 A2 对色谱柱进行流洗。
7. 用 20 CV 的缓冲液 A3(以半工作流速)洗脱并收集 pDNA。
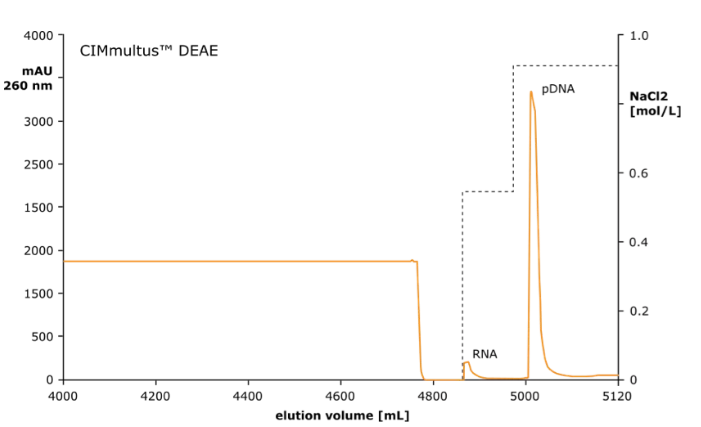
图 1:AEX CIMmultus™DEAE(2μm)柱上的质粒 DNA 洗脱曲线

 在高配体密度丁基修饰的(CIMmultus TM C4 HLD)整体柱上,利用疏水相互作用色谱柱(HIC)的抛光步骤,进一步从 超螺旋(SC)治疗级 pDNA 中除去开环(OC)和线性 pDNA 亚型。
在高配体密度丁基修饰的(CIMmultus TM C4 HLD)整体柱上,利用疏水相互作用色谱柱(HIC)的抛光步骤,进一步从 超螺旋(SC)治疗级 pDNA 中除去开环(OC)和线性 pDNA 亚型。
 为了富集质粒 DNA 的超螺旋亚型,将 DEAE 洗脱液上样到高配体密度丁基柱(C4 HLD)上。
为了富集质粒 DNA 的超螺旋亚型,将 DEAE 洗脱液上样到高配体密度丁基柱(C4 HLD)上。
 该步骤进一步去除了杂质。
该步骤进一步去除了杂质。
层析条件
Monolithic column: | CIMmultus™ C4 HLD (2 µm)*2 |
Mobile phase: | Equilibration buffer B0: 50 mM Tris, 10 mM EDTA, 3 M (NH4)2SO4, pH 7.2 |
Washing buffer B1: 50 mM Tris, 10 mM EDTA, 1.7 M (NH4)2SO4, pH 7.2 | |
Adjustment buffer: 4 M (NH4)2SO4 | |
Elution buffer B2: 50 mM Tris, 10 mM EDTA, 0.4 M (NH4)2SO4 , pH 7.2 | |
Regeneration buffer A1: 50 mM Tris, 10 mM EDTA, pH 7.2 | |
Working flow rates: | 0.5 – 5 CV/min (具体取决于样品特性、使用的层析设备和色谱柱尺寸) |
*2 选择色谱柱体积,取决于需要处理的样品量。
层析方法
1. 调节来自 DEAE 柱的含 pDNA 洗脱液,每 1 体积(V)洗脱液加入 3 体积(V)的 4M(NH4)2SO4。
2. 用 20CV 的缓冲液 B0 来平衡 C4 HLD 柱。
3. 将 DEAE 柱洗脱的 pDNA 组份上样。
4. 用 20 CV 的缓冲液 B1 流洗色谱柱。
5. 用缓冲液 B2(以半工作流速)洗脱并收集 pDNA。
6. 用 30 CV 的缓冲液 A1 再生色谱柱。
7. 加样 3 次后,对柱子进行清洗。
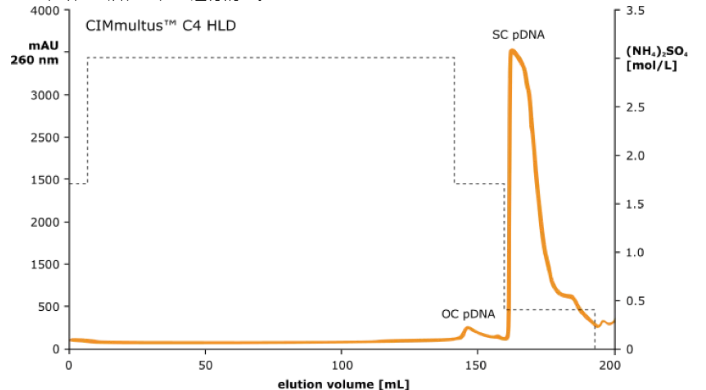
图 2:在 HIC CIMmultus TM C4 HLD(2μm)柱上分离超螺旋质粒 DNA

· 从 C4 HLD 柱洗脱的超螺旋 pDNA 组份含有硫酸铵,必须在生物应用质粒之前将其除去。
· 缓冲液交换可通过透析滤过或体积排除色谱等方法进行。
· 配置和填充可能需要额外的处理。
二步法层析过程分析:
 质粒 DNA 制造成功的关键是实时过程控制方法,确保最终产品中高百分比的超螺旋 pDNA。
质粒 DNA 制造成功的关键是实时过程控制方法,确保最终产品中高百分比的超螺旋 pDNA。
 CIMac™pDNA 分析柱可用于监测降解产物(开环和线性 pDNA),去除杂质(RNA),并确保每个生产步骤都能产生预期的超螺旋 pDNA 量。
CIMac™pDNA 分析柱可用于监测降解产物(开环和线性 pDNA),去除杂质(RNA),并确保每个生产步骤都能产生预期的超螺旋 pDNA 量。
 CIMac™pDNA 分析柱还用于超螺旋质粒 DNA 含量的质量控制。
CIMac™pDNA 分析柱还用于超螺旋质粒 DNA 含量的质量控制。
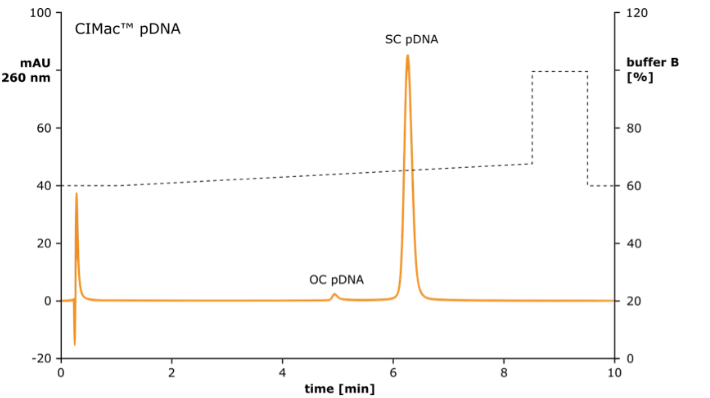
图 3:使用 CIMac™pDNA-0.3 分析柱的质粒 DNA 亚型含量的质量控制
结果和结论:
 通过优化裂解、沉淀和两种色谱步骤相结合,可生产满足所有监管要求的纯 pDNA。
通过优化裂解、沉淀和两种色谱步骤相结合,可生产满足所有监管要求的纯 pDNA。
 可以完成去除 99% 以上的主要杂质(RNA,基因组 DNA,宿主细胞蛋白,内毒素和开环 pDNA)。
可以完成去除 99% 以上的主要杂质(RNA,基因组 DNA,宿主细胞蛋白,内毒素和开环 pDNA)。
 此外,快速(大肠杆菌的 pDNA 提取和纯化可在几小时内完成),可重复的过程可降低运营成本并提高工厂生产率。
此外,快速(大肠杆菌的 pDNA 提取和纯化可在几小时内完成),可重复的过程可降低运营成本并提高工厂生产率。
 *的整体特性有助于该过程的直接可扩展性,涵盖从小规模实验室到大规模工业纯化 pDNA 的生产水平。
*的整体特性有助于该过程的直接可扩展性,涵盖从小规模实验室到大规模工业纯化 pDNA 的生产水平。
Table 1: Process results.
Process yield | > 80 % |
A260/280 | 1.92 |
Homogeneity (SC pDNA) | > 97 % |
HCD – removed | > 99.5 % |
HCP - removed | > 99 % |
Endotoxin | < 2 EU/mg pDNA |
RNA - removed | > 99 % |
点评
目前市面上有不少质粒纯化工艺方案,但是比较下来,BIA 二步法纯化工艺具有两大优势:
 效率明显提高
效率明显提高
只需两步色谱和高流速的整体柱色谱方案,减少工艺步骤(提高回收率)并加快纯化速度,从而显著提高生产率。
 灵活放大
灵活放大
由于特定的整体柱设计,质粒 DNA 过程可以快速扩展到更大的单位。
在 1 毫升色谱柱上设计的工艺可以轻松转移到试验和生产规模。
在 8L 色谱柱上单次运行可以产生 48 g 药物级 scDNA。
Table 2: Scale up options.
Column size | pDNA purified per cycle |
1 mL | 6 mg |
8 mL | 48 mg |
80 mL | 480 mg |
800 ml | 4.8 g |
8000 mL | 48 g |
十多年来,BIA Separations 一直是高效率质粒纯化的好选择。它不仅提供整体柱和平台模板,还提供定制的纯化服务,以*您的质粒 DNA 纯化需求。
相关产品
免责声明
- 凡本网注明“来源:化工仪器网”的所有作品,均为浙江兴旺宝明通网络有限公司-化工仪器网合法拥有版权或有权使用的作品,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已经本网授权使用作品的,应在授权范围内使用,并注明“来源:化工仪器网”。违反上述声明者,本网将追究其相关法律责任。
- 本网转载并注明自其他来源(非化工仪器网)的作品,目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品第一来源,并自负版权等法律责任。
- 如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。
 手机版
手机版 化工仪器网手机版
化工仪器网手机版
 化工仪器网小程序
化工仪器网小程序
 官方微信
官方微信 公众号:chem17
公众号:chem17
 扫码关注视频号
扫码关注视频号


















 采购中心
采购中心