药品稳定性试验箱(恒温恒湿+光照),La
新闻排行榜
更多产品展示
更多-
 药品稳定性试验箱(恒温恒湿+光
药品稳定性试验箱(恒温恒湿+光 -
 综合药品稳定性试验箱430CG
综合药品稳定性试验箱430CG综合药品稳定性试验箱 综合药品稳定性试验
-
 恒温恒湿试验箱
恒温恒湿试验箱恒温恒湿试验箱TH-T 系列恒温恒湿试验
-
 恒温恒湿培养箱Labonce-
恒温恒湿培养箱Labonce-恒温恒湿培养箱Labonce-(150C
-
 恒温恒湿试验箱Labonce-
恒温恒湿试验箱Labonce-恒温恒湿试验箱Labonce-400TH
-
 步入式恒温恒湿试验室
步入式恒温恒湿试验室步入式恒温恒湿试验室-性能指标
1
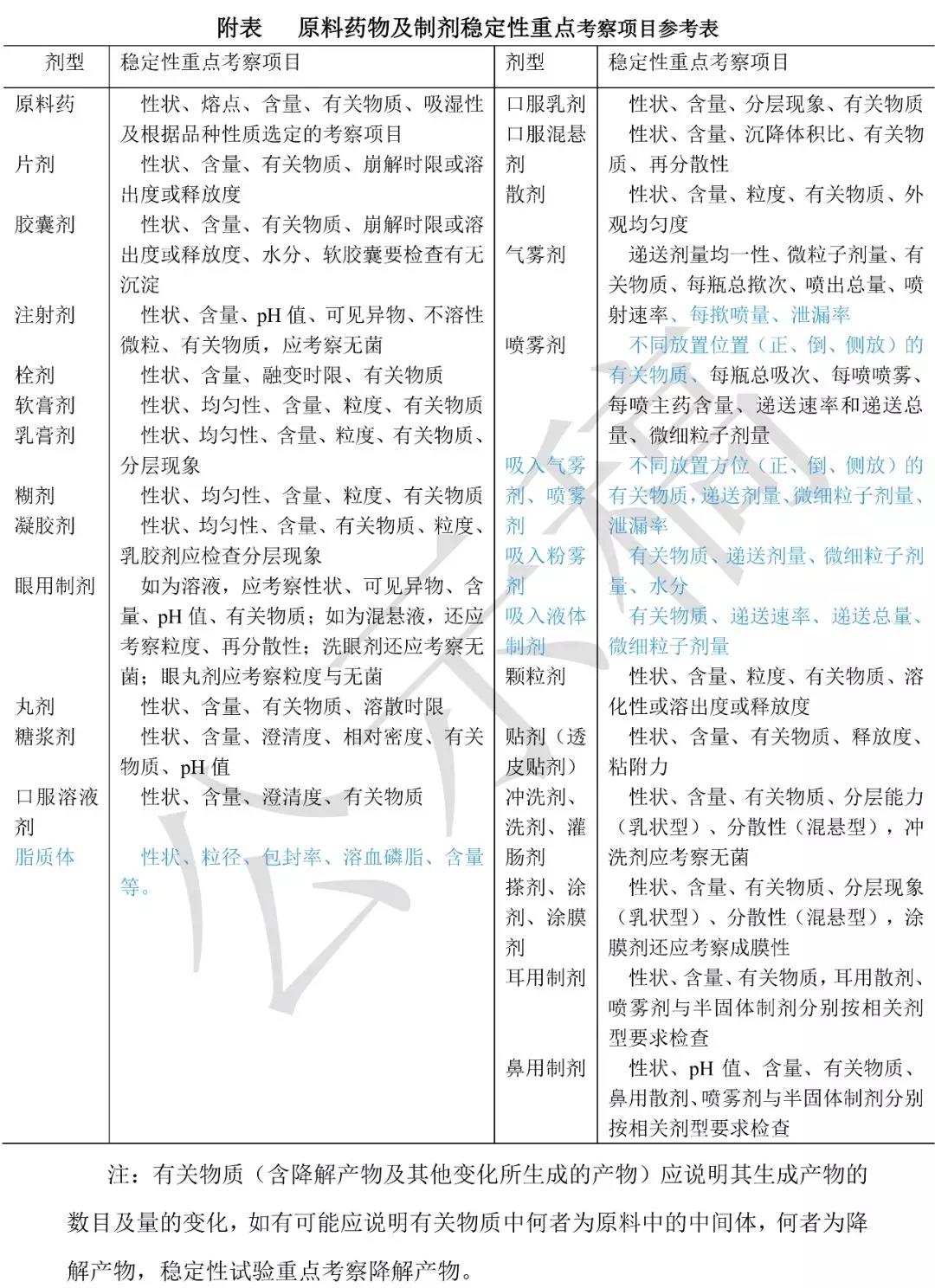
2020版《9001原料药物与制剂稳定性试验指导原则》公示稿
-
提供商
兰贝石(北京)科技有限公司
-
资料大小
410.5KB
- 资料图片
-
下载次数
497次
-
资料类型
PDF 文件

-
浏览次数
3279次
中国药典2020版稳定性试验指导原则征求意见稿
9001 原料药物与制剂稳定性试验指导原则
(标注红色表示将删除,标注蓝色表示新增)
一、原料药物
原料药物要进行以下试验。
(一)影响因素试验
此项试验是在比加速试验更激烈的条件下进行。其目的是探讨药物的固有稳定性、了解影响其稳定性的因素及可能的降解途径与降解产物,为制剂生产工艺、包装、贮存条件和建立降解产物分析方法提供科学依据。供试品可以用1批原料药物进行,将供试品置适宜的开口容器中(如称量瓶或培养皿),摊成≤5mm 厚的薄层,疏松原料药物摊成≤10mm 厚的薄层,进行以下试验。当试验结果发现降解产物有明显的变化,应考虑其潜在的危害性,必要时应对降解产物进行定性或定量分析。
(1)高温试验试品开口置适宜的洁净容器中,60℃温度下放置 10 天,于第 5天和第 10 天取样,按稳定性重点考察项目进行检测。若供试品含量低于规定限度,则在 40℃条件下同法进行试验。若 60℃:无明显变化,不再进行 40℃试验。
(2)高湿试验供试品开口置恒湿密闭容器中,在 25℃分别于相对湿度 90%±5% 条件下放置 10 天,于第 5 天和第 10 天取样,按稳定性重点考察项目要求检测,同时准确称量试验前后供试品的重量,以考察供试品的吸湿潮解性能。若吸湿增重5% 以上,则在相对湿度 75%±5%条件下,同法进行试验;若吸湿增重 5% 以下,其他考察项目符合要求,则不再进行此项试验。恒湿条件可在密闭容器如干燥器下部放置饱和盐溶液,根据不同相对湿度的要求,可以选择 NaCl 饱和溶液(相对湿度 75%±1%,15.5〜60℃),KNO3 饱和溶液(相对湿度 92.5%, 25℃) 。
(3)强光照射试验供试品开口放在装有日光灯的光照箱或其他适宜的光照装置内,光源可选择任何输出相似于 D65/ID65 发射标准的光源,或同时暴露于冷白荧光灯和近紫外灯下,并于照度为 4500Lx± 500Lx 的条件下放置 10 天,于第 5 天和第 10 天取样,按稳定性重点考察项目进行检测,特别要注意供试品的外观变化。
关于光照装置,建议采用定型设备“可调光照箱”,也可用光橱,在箱中安装日光灯数相应光源使达到规定照度。箱中供试品台高度可以调节,箱上方安装抽风机以排除可能产生的热量,箱上配有照度计,可随时监测箱内照度,光照箱应不受自然光的干扰,并保持照度恒定,同时防止尘埃进人光照箱内。
此外,根据药物的性质必要时可设计试验:原料药在溶液或混悬液状态时,或在较宽 pH 值范围探讨 pH 值与氧及其他条件应考察对药物稳定性的影响,并研究分解产物的分析方法。创新药物应对分解产物的性质进行必要的分析。冷冻保存的原料药物,应验证其在多次反复冻融条件下产品质量的变化情况。在加速或长期放置条件下已证明某些降解产物并不形成,则可不必再做专门检查。
(二)加速试验
此项试验是在加速条件下进行。其目的是通过加速药物的化学或物理变化,探讨药物的稳定性,为制剂设计、包装、运输、贮存提供必要的资料。供试品要求 3 批,按市售包装,在温度 40℃±2℃、相对湿度 75%±5%的条件下放置 6 个月。所用设备应能控制温度±2℃、相对湿度±5% ,并能对真实温度与湿度进行监测。在试验期间第 1 个月、2 个月、3 个月、6 个月末分别取样一次,按稳定性重点考察项目检测。在上述条件下,如 6 个月内供试品经检测不符合制订的质量标准,则应在中间条件下即在温度 30℃± 2℃、相对湿度 65%±5% 的情况下(可用 Na2CrO4 饱和溶液,30℃,相对湿度 64.8%)进行加速试验,时间至少 12 个月,应包括所有的考察项目,检测至少包含初始和末次的4个时间点(如 0、6、9、12 月)。加速试验,建议采用隔水式电热恒温培养箱(20〜60℃)。箱内放置具有一定相对湿度饱和盐溶液的干燥器,设备应能控制所需温度,且设备内各部分温度应该均匀,并适合长期使用。也可采用恒湿恒温箱或其他适宜设备。
对温度特别敏感的药物,预计只能在冰箱中(4〜8℃)保存,此种药物的加速试验,可在温度 25℃±2℃、相对湿度 60%±10%的条件下进行,时间为 6 个月。
对拟冷冻贮藏的药物,应对一批样品在温度(如:5℃±3℃或 25℃±2℃)下放置适当的时间进行试验,以了解短期偏离标签贮藏条件(如运输或搬运时)对药物的影响。
(三)长期试验
长期试验是在接近药物的实际贮存条件下进行,其目的是为制定药物的有效期提供依据。供试品 3 批,市售包装,在温度 25℃±2℃,相对湿度 60%± 10%的条件下放置 12 个月,或在温度 30℃±2℃、相对湿度 65%±5% 的条件下放置 12 个月,这是从我国南方与北方气候的差异考虑的,至于上述两种条件选择哪一种由研究者确定。每 3 个月取样一次,分别于 0 个月、3 个月、6 个月、9 个月、12 个月取样按稳定性重点考察项目进行检测。12 个月以后,仍需继续考察,分别于 18 个月、24 个月、36 个月,取样进行检测。将结果与 0 个月比较,以确定药物的有效期。由于实验数据的分散性,一般应按 95%可信限进行统计分析,得出合理的有效期。如 3 批统计分析结果差别较小,则取其平均值为有效期,若差别较大则取其短的为有效期。如果数据表明,测定结果变化很小,说明药物是很稳定的,则不作统计分析。
对温度特别敏感的药物,长期试验可在温度 6℃± 2℃的条件下放置 12 个月,按上述时间要求进行检测,12 个月以后,仍需按规定继续考察,制订在低温贮存条件下的有效期。
对拟冷冻贮藏的药物,长期试验可在温度-20℃±5℃的条件下至少放置 12个月。
长期试验采用的温度为 25℃±2℃、相对湿度为 60%±10%,或温度 30℃±2℃、相对湿度 65%±5%,是根据气候带制定的。气候带见下表。
二、药物制剂
药物制剂稳定性研究,首先应查阅原料药物稳定性有关资料,特别了解温度、湿度、光线对原料药物稳定性的影响,并在处方筛选与工艺设计过程中,根据主药与辅料性质,参考原料药物的试验方法,进行影响因素试验、加速试验与长期试验, 符合一定条件可以应用括号法和矩阵法简化试验方案。
(一)影响因素试验
药物制剂进行此项试验的目的是考察制剂处方的合理性与生产工艺及包装条件。供试品用 1 批进行,将供试品如片剂、胶囊剂、注射剂(注射用无菌粉末如为西林瓶装,不能打开瓶盖,以保持严封的完整性),除去外包装,置适宜的开口容器中,进行髙温试验、高湿度试验与强光照射试验,试验条件、方法、取样时间与原料药相同,重点考察项目见附表。
对于需冷冻保存的中间产物或药物制剂,应验证其在多次反复冻融条件下产品质量的变化情况。
(二)加速试验
此项试验是在加速条件下进行,其目的是通过加速药物制剂的化学或物理变化,探讨药物制剂的稳定性,为处方设计、工艺改进、质量研究、包装改进、运输、贮存提供必要的资料。供试品要求 3 批,按市售包装,在温度 40℃±2℃、相对湿度 75%±5% 的条件下放置 6 个月。所用设备应能控制温度±2℃、相对湿度±5%,并能对真实温度与湿度进行监测。在试验期间第 1 个月、2 个月、3个月、6 个月末分别取样一次,按稳定性重点考察项目检测。在上述条件下,如 6 个月内供试品经检测不符合制订的质量标准,则应在中间条件下即在温度 30℃ ±2℃、相对湿度 65%±5%的情况下进行加速试验,时间至少 12 个月,应包括所有的考察项目,检测至少包含初始和末次的 4 个时间点(如 0、6、9、12 月)。
溶液剂、混悬剂、乳剂、注射液等含有水性介质的制剂可不要求相对湿度。试验所用设备与原料药物相同。
对温度特别敏感的药物制剂,预计只能在冰箱(4〜8℃)内保存使用,此类药物制剂的加速试验,可在温度 25℃±2℃,相对湿度 60% ±10%的条件下进行,时间为 6 个月。
对拟冷冻贮藏的制剂,应对一批样品在温度(如:5℃±3℃或 25℃±2℃)下放置适当的时间进行试验,以了解短期偏离标签贮藏条件(如运输或搬运时)对制剂的影响。
乳剂、混悬剂、软膏剂、乳膏剂、糊剂、凝胶剂、眼膏剂、栓剂、气雾剂、泡腾片及泡腾颗粒宜直接采用温度 30℃±2℃、相对湿度 65%±5%的条件进行试验,其他要求与上述相同。
对于包装在半透性容器中的药物制剂,例如低密度聚乙烯制备的输液袋、塑料安瓿、眼用制剂容器等,则应在温度 40℃±2℃、相对湿度 25%±5%的条件(可用 CH3COOK•1.5 H2O 饱和溶液)进行试验。
(三)长期试验
长期试验是在接近药品的实际贮存条件下进行,其目的是为制订药品的有效期提供依据。供试品 3 批,市售包装,在温度 25℃±2℃、相对湿度 60%±10%的条件下放置 12 个月,或在温度 30℃±2℃、相对湿度 65%±5% 的条件下放置 12 个月,这是从我国南方与北方气候的差异考虑的,至于上述两种条件选择哪一种由研究者确定。每 3 个月取样一次,分别于 0 个月、3 个月、6 个月、9个月、12 个月取样,按稳定性重点考察项目进行检测。12 个月以后,仍需继续考察,分别于 18 个月、24 个月、36 个月取样进行检测。将结果与 0 个月比较以确定药品的有效期。由于实测数据的分散性,一般应按 95%可信限进行统计分析,得出合理的有效期。如 3 批统计分析结果差别较小,则取其平均值为有效期限。
若差别较大,则取其短的为有效期。数据表明很稳定的药品,不作统计分析。
对温度特别敏感的药品,长期试验可在温度 6℃±2℃的条件下放置 12 个月,按上述时间要求进行检测,12 个月以后,仍需按规定继续考察,制订在低温贮存条件下的有效期。
对拟冷冻贮藏的制剂,长期试验可在温度-20℃±5℃的条件下至少放置 12 个月,货架期应根据长期试验放置条件下实际时间的数据而定。
对于包装在半透性容器中的药物制剂,则应在温度 25℃±2℃、相对湿度 40%±5%,或 30℃±2℃、相对湿度 35%±5%的条件进行试验,至于上述两种条件选择哪一种由研究者确定。
对于生物制品,应充分考虑运输路线、交通工具、距离、时间、条件(温度、湿度、振动情况等)、产品包装(外包装、内包装等)、产品放置和温度监控情况(监控器的数量、位置等)等对产品质量的影响。
此外,有些药物制剂还应考察临用时配制和使用过程中的稳定性。例如,应对配制或稀释后使用、在特殊环境(如高原低压、海洋高盐雾等环境)使用的制剂开展相应的稳定性研究,同时还应对药物的配伍稳定性进行研究,为说明书/标签上的配制、贮藏条件和配制或稀释后的使用期限提供依据。
 您好, 欢迎来到化工仪器网
您好, 欢迎来到化工仪器网

 10
10